ترتيب العناصر حسب الكهروسالبية
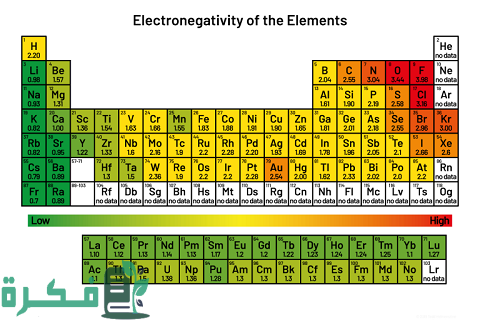
ترتيب العناصر حسب الكهروسالبية من الأمور الهامة التي يجب معرفتها لقياس مقدار الذرة في الأجزاء التساهمية بجذب إلكترونيات الروابط الكيميائية، ومن مقالنا سنوضح هذا الترتيب ونتناول تعريف الكهروسالبية عبر موقع فكرة.
عناصر المقال
ترتيب العناصر حسب الكهروسالبية
إن العلماء يهتمون بالأبحاث والدراسات الكيمائية، وذلك لدخولها في العديد من الأشياء لذلك نشير إلى ما يلي:
- قام العالم الأمريكي لينوس كارل بولينج بترتيب العناصر اعتمادًا على السالبية الكهربية وأصبحت العملية تتم بمقياس بولينج.
- يعد هذا العالم حاصل على جائزة نوبل في الكيمياء هو المسؤول عن تطوير الجدول الدوري الحديث.
- ترتيب العناصر بشكل جدول دوري الهالوجينات.
- يتم الترتيب وفق السالبية الكهربية.
- يعد الفلور أكثر العناصر سالبية حيث تعد قيمته 3.98.
- أما الفرانسيوم يعد الأقل نسبة حيث تعد قيمته 0.7.
اقر ايضًا : كيفية ترتيب الملفات في المكتب
تعريف السالبية الكهربية
إن السالبية الكهربية تعد طاقة الذرة، ومدى قدرتها على الجذب الخاص بالإلكترونات حتى تتوافق بعدها مع ذرة أخرى وبدأوا في تشكيل رابط كيميائي، ونشير إلى التالي:
- حجم الذرة يؤثر بشكل كبير في عملية الطاقة الجاذبة، وهذا يعني أنه كلما كبر حجم الذرة استطاعت اكتساب قوة أكثر في جذب الإلكترونات.
- كلما زادت الاختلافات في السالبية الكهربية بين الذرتين أصبحت الكثافة الإلكترونية التي نشأت في محيطهما أكبر.
خواص العناصر الكهروسالبية
من خلال حديثنا عن ترتيب العناصر حسب الكهروسالبية نعرض خصائصها، وهي:
- إن اتجاه العناصر من أعلى إلى أسفل يعبر عن قلة السالبية الكهربية مع زيادة الحجم الذري الذي يخص كل عنصر، ومع هذا يحدث التنافر في المستويات الأخيرة من الطاقة، وذلك بسبب أن النواة تكون في حالة فقد القدرة على جذب الإلكترونات.
- الفلزات تعد من العناصر الأقل سلبية وهذا بسبب كبر نصف قطرها، وبالطبع تكون عكس العناصر التي تصنف باللافلزات التي يكون نصف قطرها صغير.
- إن العناصر في الجدول الدوري كلما اتجهنا بها من اليسار إلى اليمين زادت السالبية الكهربية الخاصة بها وقل الحجم الذري.
- كما أن العناصر التي تتميز بالسالبية العالية توجد بأعلى الجدول الدوري أما التي توجد في الأسفل هي الأقل سلبية.
- العناصر العالية في السالبية الكهربية في الجدول من عناصر المجموعة 17 هي التي يدخل بها الهالوجينات والأكسجين وكذلك النيتروجين، أما الأقل هي التي يدخل فيها الفلزات القلوية من المجموعة الأولى والثانية.
الجدير بالذكر أنه يوجد بعض العناصر التي تتكون من مجموعة كبيرة لم تحدد سالبيتها الكهربية:
- يطلق عليها الغازات النبيلة، فلا تكون مركبات، ولكنها في أحيانًا معينة نادرة تكون مركبات من الغازات النبيلة.
- تكون في هذا الوقت ذات سالبية عالية لتتشابه مع مجموعات الهالوجينات.
اقر ايضًا : ترتيب العناصر حسب طاقة التأين
السالبية الكهربية لعناصر الجدول الدوري
اعتمادًا على قانون بولينج في حساب السالبية الكهربية كان من الممكن تحديد القيمة الخاصة بعناصر الجدول الدوري، فأصبح العلماء على علم بمقدار الهيدروجين إلى الإتيريوم، وحتى الآن مستثناة من هذه القائمة العناصر الخاملة والغازات النبيلة ونذكر لكم البعض فيما يلي:
| الليثيوم 0.98 |
| النيتروجين 1.04 |
| الكربون 2.55 |
| الصوديوم 0.93 |
| السيلكون 1.9 |
| الهيدروجين 2.2 |
| النيكل 1.91 |
| الزنك 1.65 |
| الكروميوم 1.66 |
| التيتانيوم 1.54 |
| الفسفور 2.19 |
| السترونشيوم 0.95 |
| الأنتيمون 2.05 |
| الساماريوم 1.17 |
| الإربيوم 1.24 |
| كوبالت 1.88 |
| المنجنيز 1.55 |
| الأكسجين 3.44 |
| البوتاسيوم 0.82 |
| البيرليوم 1.57 |
| النحاس 1.9 |
طريقة موليكن في حساب السالبية الكهربية
في موضوعنا ترتيب العناصر حسب الكهروسالبية نشير إلى أنه على الرغم من أن هذه الطريقة معترف بها إلا أنها لم تعتمد من جهة دارسي علوم الكيمياء لأنها ليست بفعالية طريقة بولينج حيث:
- طريقة موليكن لحساب السالبية واحدة من ضمن الطرق القديمة المستخدمة في هذا الأمر.
- تعتمد في فكرتها الأساسية على طاقة الألفا الإلكترونية الخاصة بالعنصر.
- أصدر معادلة خاصة به تمكن من بعده في حساب الكهروسالبية وهي
X = (E i + E ea).
اقر ايضًا : ترتيب العناصر حسب درجة الانصهار
الجداول والمعادلات الكيميائية لا تساعد الباحثين فقط في التوصل إلى اكتشافات جديدة بل تساعد الدارسين أيضًا في منحهم العقل الواعي والقدرة على الاستيعاب.
أسئلة شائعة
-
هل السالبية الكهربية للفضة 1.93؟
نعم.
-
ما السالبية الكهربية لليود؟
2.66
-
كم السالبية الكهربية للقصدير؟
1.96


